Trong quá trình học tập về hóa học, chúng ta thường gặp phải nhiều phản ứng hóa học thú vị và hấp dẫn. Hôm nay, chúng ta sẽ khám phá phản ứng HNO3 + CuO. Đây là một trong những phản ứng phổ biến và hữu ích mà chúng ta nên nắm vững. Các bạn hãy cùng ihoc tìm hiểu nhé!
Axit nitric (HNO3) và oxit đồng (CuO)
Axit nitric (HNO3)
Axit nitric (HNO3) là một trong những axit quan trọng và phổ biến nhất trong hóa học. Được biết đến với tên gọi “axit nitric,” nó là một chất oxi hóa mạnh có khả năng tác động lên nhiều loại chất hữu cơ và vô cơ.
Công thức hóa học của HNO3 là HNO3, trong đó H đại diện cho nguyên tử hydro, N đại diện cho nguyên tử nitơ và O đại diện cho nguyên tử oxi.
Tính chất của axit nitric:
- Dạng lỏng không màu, có mùi hắc đặc trưng.
- Tan tốt trong nước, tạo thành dung dịch axit nitric.
- Là một chất oxi hóa mạnh, có khả năng cấp electron hoặc nhận proton để tạo ra các ion nitrat.
Oxit đồng (CuO)
Oxit đồng (CuO) là một hợp chất vô cơ của đồng với oxi, được tạo thành khi đồng tác động với oxi hoặc khi oxi hoá đồng.
Công thức hóa học của CuO là CuO, trong đó Cu đại diện cho nguyên tử đồng và O đại diện cho nguyên tử oxi.
Tính chất của oxit đồng:
- Dạng bột màu đen với cấu trúc tinh thể.
- Không tan trong nước, tuy nhiên, có thể phản ứng với axit hoặc dung dịch kiềm để tạo ra các muối đồng như nitrat đồng (Cu(NO3)2) hoặc hidroxit đồng (Cu(OH)2).
Mối quan hệ giữa HNO3 và CuO
Axit nitric (HNO3) và oxit đồng (CuO) có mối quan hệ trong phản ứng hóa học, nơi HNO3 tác động lên CuO để tạo ra các sản phẩm mới.
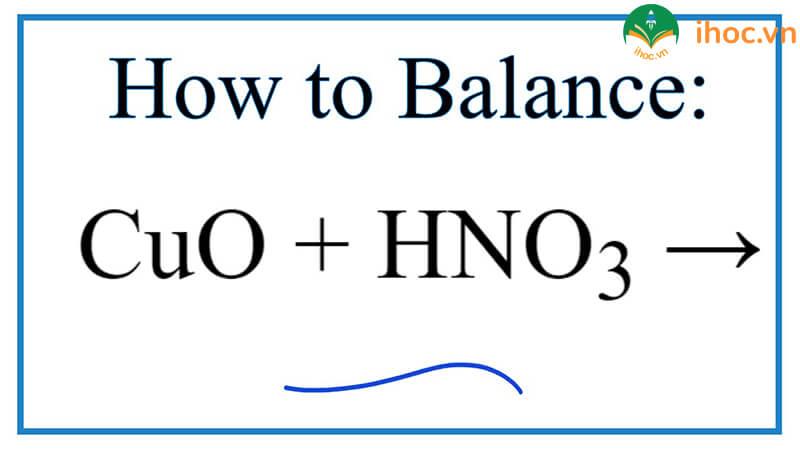
Phản ứng giữa HNO3 và CuO:
- HNO3 + CuO -> Cu(NO3)2 + H2O
Khi HNO3 tác động lên CuO, các nguyên tử oxi trong CuO được cấp electron bởi HNO3, tạo thành các ion nitrat (Cu(NO3)2) và nước (H2O).
Ý nghĩa và ứng dụng của HNO3 và CuO
- Axit nitric (HNO3) có nhiều ứng dụng quan trọng trong công nghiệp hóa chất, sản xuất phân bón, chất tẩy rửa và trong một số quá trình hóa học quan trọng khác.
- Oxit đồng (CuO) được sử dụng trong công nghệ điện tử để sản xuất vi mạch và linh kiện điện tử. Nó cũng được dùng trong sản xuất gốm sứ và trong một số ứng dụng y học như là một chất chữa bệnh.
Tìm hiểu về axit nitric (HNO3) và oxit đồng (CuO) giúp chúng ta hiểu rõ hơn về tính chất và phản ứng hóa học của chúng, đồng thời khám phá những ứng dụng quan trọng trong cuộc sống và các lĩnh vực công nghiệp khác.
Tìm hiểu thêm: NaCl ra Na: Tìm hiểu về phản ứng hoá học đặc biệt của muối natri
Phản ứng giữa HNO3 và CuO

Phương trình hóa học của phản ứng
Phản ứng giữa axit nitric (HNO3) và oxit đồng (CuO) được biểu diễn bằng phương trình hóa học sau:
- HNO3 + CuO → Cu(NO3)2 + H2O
Cơ chế phản ứng và giải thích chi tiết
Phản ứng giữa HNO3 và CuO là một phản ứng oxi hóa - khử. Trong quá trình này, axit nitric (HNO3) tác động lên oxit đồng (CuO), chuyển đổi các nguyên tử trong cấu trúc của chúng và tạo ra các sản phẩm mới.
Chi tiết cơ chế phản ứng:
- Trong HNO3, nguyên tử nitơ (N) có số oxi hoá +5, trong khi nguyên tử oxi (O) có số oxi hoá -2.
- Trong CuO, nguyên tử đồng (Cu) có số oxi hoá +2, và nguyên tử oxi (O) có số oxi hoá -2.
Khi axit nitric (HNO3) tác động lên oxit đồng (CuO), cơ chế phản ứng xảy ra như sau:
- Nguyên tử nitơ trong HNO3 cấp electron cho nguyên tử oxi trong CuO, làm cho số oxi hoá của nitơ giảm từ +5 xuống +2.
- Nguyên tử đồng trong CuO nhận electron từ nguyên tử nitơ, làm cho số oxi hoá của đồng tăng từ +2 lên +4.
- Trong quá trình này, nguyên tử oxi từ CuO tạo thành nước (H2O), còn nguyên tử nitơ từ HNO3 tạo thành các ion nitrat (NO3-) có thể kết hợp với ion đồng tạo thành muối đồng (Cu(NO3)2).
Sản phẩm và tính chất của sản phẩm
Sản phẩm chính của phản ứng giữa HNO3 và CuO là muối đồng nitrat (Cu(NO3)2) và nước (H2O).
- Muối đồng nitrat (Cu(NO3)2):
- Là một chất rắn màu xanh lá cây.
- Có tính chất hòa tan tốt trong nước, tạo thành dung dịch màu xanh.
- Có ứng dụng trong nhiều lĩnh vực như sản xuất mực in, thuốc nhuộm, và trong lĩnh vực luyện kim.
- Nước (H2O):
- Là một chất lỏng trong suốt, không màu, và có mùi đặc trưng.
- Là chất quan trọng trong cuộc sống và được sử dụng trong nhiều mục đích, từ uống, nấu ăn, cho đến các ứng dụng công nghiệp và sản xuất.
Phản ứng giữa HNO3 và CuO là một ví dụ minh họa về cơ chế oxi hóa - khử trong hóa học. Điều này giúp chúng ta hiểu rõ hơn về quá trình phản ứng hóa học giữa các chất và tính chất của sản phẩm tạo thành.
Xem thêm: Phản ứng AlCl3 NH3: Cơ chế, ứng dụng và tính chất hóa học
Ứng dụng và tác dụng trong thực tế
Liên hệ giữa phản ứng HNO3 và CuO với các ứng dụng trong cuộc sống hàng ngày
Phản ứng giữa axit nitric (HNO3) và oxit đồng (CuO) có một số liên hệ quan trọng với cuộc sống hàng ngày của chúng ta:
- Sản xuất muối đồng nitrat (Cu(NO3)2): Muối đồng nitrat (Cu(NO3)2) là sản phẩm chính của phản ứng này và có ứng dụng rộng rãi trong nhiều lĩnh vực. Nó được sử dụng trong công nghiệp mực in, thuốc nhuộm, xử lý bề mặt kim loại, và trong lĩnh vực chế tạo gương phản chiếu ánh sáng.
- Thực hiện các thí nghiệm hóa học: Phản ứng HNO3 và CuO được sử dụng trong các thí nghiệm hóa học tại trường học và trung tâm nghiên cứu để giảng dạy và nghiên cứu về phản ứng oxi hóa - khử và tính chất của muối đồng nitrat tạo thành.
Tác dụng của phản ứng trong công nghiệp và môi trường
Phản ứng giữa HNO3 và CuO cũng có một số tác dụng quan trọng trong công nghiệp và môi trường:
- Công nghiệp điện tử: Muối đồng nitrat (Cu(NO3)2) được sử dụng làm chất chủ vị và chất ổn định để tạo ra vi mạch và linh kiện điện tử. Nó cũng có vai trò quan trọng trong sản xuất chip vi xử lý và các sản phẩm điện tử khác.
- Môi trường: Sự tác động của axit nitric (HNO3) vào các chất oxi hóa trong môi trường có thể gây hại đến hệ sinh thái. HNO3 thường xuất hiện trong các hạt gió, gây ra hiện tượng mưa axit khi hòa tan vào nước trong không khí. Mưa axit gây ô nhiễm môi trường, làm suy giảm chất lượng đất và nước, và ảnh hưởng đến sức khỏe con người và động vật.
- Công nghiệp hóa chất: HNO3 được sử dụng trong sản xuất phân bón và chất tẩy rửa. Trong công nghiệp, phản ứng HNO3 và CuO có thể được sử dụng làm một trong những phương pháp để sản xuất các hợp chất có tính chất oxi hóa hoặc khử quan trọng khác.
Tóm lại, phản ứng giữa HNO3 và CuO không chỉ có ứng dụng trong cuộc sống hàng ngày của chúng ta như trong sản xuất muối đồng nitrat, mà còn có tác dụng quan trọng trong công nghiệp và môi trường. Hiểu rõ về các tác dụng này giúp chúng ta nhận thức được sự quan trọng và tác động của phản ứng hóa học trong cuộc sống và môi trường xung quanh.
Cách thực hiện thí nghiệm
Hướng dẫn cụ thể và an toàn khi thực hiện thí nghiệm HNO3 + CuO:
Lưu ý quan trọng: Phản ứng giữa axit nitric (HNO3) và oxit đồng (CuO) là một phản ứng hóa học mạnh mẽ và cần được thực hiện dưới sự hướng dẫn của giáo viên hoặc người có kinh nghiệm trong môi trường phòng thí nghiệm.
- Chuẩn bị trang thiết bị:
- Cân điện tử để cân chính xác lượng HNO3 và CuO cần dùng.
- Dụng cụ pha chế để đo và trộn chính xác dung dịch axit nitric.
- Lọ nước và bình chứa dung dịch thải để tiện việc xử lý chất thải sau khi thí nghiệm kết thúc.
- Kính bảo hộ, găng tay, áo khoác phòng thí nghiệm và kính bảo vệ mắt để đảm bảo an toàn khi thực hiện thí nghiệm.
- Chuẩn bị các hóa chất:
- Mua HNO3 và CuO ở dạng hóa chất đáp ứng tiêu chuẩn an toàn và chất lượng.
- Cất giữ HNO3 trong lọ chứa đậy kín để tránh tác động với không khí và ánh sáng.
Thực hiện thí nghiệm:
- Đeo đồ bảo hộ đầy đủ trước khi bắt đầu thực hiện thí nghiệm.
- Dùng cân điện tử để cân chính xác một lượng nhất định của CuO và đặt vào một ống nghiệm hoặc bát hóa chất.
- Đo lượng HNO3 cần dùng theo tỷ lệ phù hợp và rót vào ống nghiệm chứa CuO. Lưu ý rót HNO3 vào CuO từ từ để tránh phản ứng quá mạnh.
An toàn khi thực hiện:
- Tránh hít phải hơi HNO3, đặc biệt là khi rót vào CuO.
- Giữ khoảng cách đủ xa giữa mắt và dung dịch khi đang thực hiện.
- Tránh tiếp xúc trực tiếp với HNO3 và CuO, và giữ chúng ra xa tầm tay của trẻ em.
- Đặt bát chứa dung dịch thải gần để thu gom và xử lý an toàn các chất thải sau khi thí nghiệm kết thúc.
Kết quả thí nghiệm và cách quan sát:
- Sau khi thêm HNO3 vào CuO, sẽ xuất hiện một phản ứng giữa hai chất.
- Quan sát sự biến đổi của hỗn hợp sau khi phản ứng diễn ra. Sản phẩm muối đồng nitrat (Cu(NO3)2) sẽ xuất hiện trong hỗn hợp, và có thể nhìn thấy màu xanh lá cây đặc trưng của muối này.
- Các biểu hiện của phản ứng có thể bao gồm sự tạo bọt khí, phát nhiệt hoặc thay đổi nhiệt độ của hỗn hợp.
Quan sát kết quả thí nghiệm sau khi phản ứng xảy ra rất quan trọng để hiểu rõ cơ chế phản ứng và tính chất của sản phẩm. Sau khi kết thúc thí nghiệm, đảm bảo thu gom và xử lý an toàn chất thải phản ứng theo quy trình hợp lý.
Bài tập

Bài tập 1: Xác định lượng Cu(NO3)2 và H2O tạo thành sau khi phản ứng 16g HNO3 với 20g CuO.
Giải:
Ta sử dụng phương trình phản ứng: HNO3 + CuO → Cu(NO3)2 + H2O
Xác định số mol của từng chất:
- Mol HNO3 = khối lượng HNO3 / khối lượng phân tử HNO3 = 16g / (1g/mol + 14g/mol + 3x16g/mol) ≈ 16g / 63g/mol ≈ 0.254 mol
- Mol CuO = khối lượng CuO / khối lượng phân tử CuO = 20g / (63.5g/mol + 16g/mol) ≈ 20g / 79.5g/mol ≈ 0.252 mol
Phản ứng HNO3 và CuO theo tỉ lệ số mol là 1:1. Vì số mol của HNO3 và CuO gần nhau, nên phản ứng sẽ xảy ra hoàn toàn, không dư dùng chất nào.
Vậy, sau phản ứng, ta thu được 0.254 mol Cu(NO3)2 và 0.254 mol H2O.
Ví dụ minh họa
Trong một bài thí nghiệm hóa học, bạn đang nghiên cứu về phản ứng giữa HNO3 và CuO. Bạn đã chuẩn bị 15g HNO3 và 10g CuO để thực hiện phản ứng.
Sau khi phản ứng diễn ra, bạn quan sát thấy một hiện tượng phát nhiệt xảy ra và màu xanh lá cây của muối đồng nitrat (Cu(NO3)2) được hình thành. Bạn muốn xác định lượng Cu(NO3)2 và H2O tạo thành sau khi phản ứng hoàn tất.
Giải:
Sử dụng phương trình phản ứng: HNO3 + CuO → Cu(NO3)2 + H2O
Xác định số mol của từng chất:
- Mol HNO3 = khối lượng HNO3 / khối lượng phân tử HNO3 = 15g / (1g/mol + 14g/mol + 3x16g/mol) ≈ 15g / 63g/mol ≈ 0.238 mol
- Mol CuO = khối lượng CuO / khối lượng phân tử CuO = 10g / (63.5g/mol + 16g/mol) ≈ 10g / 79.5g/mol ≈ 0.126 mol
Phản ứng HNO3 và CuO theo tỉ lệ số mol là 1:1. Vì số mol của HNO3 lớn hơn số mol của CuO, nên CuO sẽ hết trong phản ứng và HNO3 còn dư sau khi phản ứng hoàn tất.
Vậy, sau phản ứng, ta thu được 0.126 mol Cu(NO3)2 và 0.112 mol H2O. Chất HNO3 dư 0.112 mol.
Ví dụ trên giúp hiểu rõ hơn về phản ứng giữa HNO3 và CuO, cách tính toán số mol và xác định sản phẩm tạo thành sau khi phản ứng diễn ra.
Xem thên: Phản ứng HNO3 ra NO2: Công thức, cơ chế và ứng dụng
Hy vọng thông qua việc tìm hiểu về phản ứng HNO3 + CuO, chúng ta đã có cái nhìn tổng quan về sự tương tác giữa các chất hóa học và các ứng dụng hữu ích của chúng trong cuộc sống và công nghiệp. Hóa học là một lĩnh vực rộng lớn và đa dạng, luôn đem lại những điều mới mẻ để khám phá và ứng dụng.Các bạn hãy đón đọc thêm những bài viết khác của ihoc để có thêm nhiều kiến thức hóa học hữu ích nhé!


